Yeni bir çalışma, biyomedikal bir aracın, gelişmekte olan fetal beyin hücrelerindeki hatalı genleri düzenlemek için genetik materyali başarılı bir şekilde sunabileceğini gösteriyor. Farelerde test edilen teknoloji, Angelman sendromu ve Rett sendromu gibi genetik olarak belirlenmiş nörogelişimsel bozuklukların ilerlemesini doğumdan önce durdurma potansiyeline sahip olabilir.
Bu aracın nörogelişimsel bozuklukların tedavisindeki etkileri çok büyüktür. Beyin gelişiminin kritik dönemlerinde genetik anormallikleri temel düzeyde potansiyel olarak düzeltebiliriz.
Aijun Wang, çalışmanın kıdemli yazarı ve California Üniversitesi Davis’te cerrahi ve biyomedikal mühendisliği profesörü
Berkeley’deki California Üniversitesi’ndeki Wang Laboratuvarı ve Murthy Laboratuvarı arasındaki ortak çalışma ACS Nano’da yayınlandı. Ekip, bu teknolojiyi doğum öncesi testler sırasında teşhis edilebilecek genetik hastalıkların tedavilerine yönelik olarak geliştirmeyi umuyor. Hücreler gelişip olgunlaştıkça daha fazla hasarı önlemek için tedavi rahim içinde yapılabilir.
Proteinler vücudumuzun işleyişinde önemli bir rol oynar. Haberci RNA’dan (mRNA) gelen “talimatlara” göre hücrelerde birleştirilirler. Belirli koşullar altında genler vücudun ihtiyaç duyduğundan daha fazla veya daha az protein ifade eder (üretir). Bu gibi durumlarda vücudun aşırı aktif geni “kapatması” veya düşük protein seviyesini değiştirmesi gerekecektir.
“Proteinlerin büyük ve karmaşık yapıları var, bu da onların teslim edilmesini zorlaştırıyor. Onların teslimatı hala büyük bir zorluk ve hastalıkların tedavisi için bir rüya olmaya devam ediyor” dedi Wang.
Bilim insanları, proteinleri iletmek yerine mRNA’yı hücrelere iletmenin ve hücrelerin içindeki fonksiyonel proteinlere çevrilecek bir yol bulmayı başardılar. Bu dağıtım yöntemi, mRNA’yı taşımak için benzersiz bir lipit nanopartikülleri (LDL) formülasyonu kullanır. Amaç, mRNA genetik materyalini hücrelere tanıtmak (transfekte etmektir). Daha sonra mRNA, proteinleri oluşturmak için talimatları çevirecektir.
LNP’ler kullanılarak mRNA’nın sağlanması halihazırda hastalık tedavilerini dönüştürüyor. Aşı geliştirmede, gen düzenlemede ve protein replasman tedavisinde kullanılır. mRNA dağıtımı son zamanlarda Pfizer ve Moderna’nın COVID-19 aşılarında kullanılmasıyla daha popüler hale geldi.
Wang, Murthy ve ekibi, çalışmalarında mRNA’nın güvenli ve etkili bir şekilde iletilmesi için yeni bir LNP formülasyonu tanımladılar. MRNA taşıyan LNP’lerin, endositoz olarak bilinen bir süreç yoluyla “alındıkları” hücrelere “varmaları” gerekir. Burada hücre, LNP taşıyıcısını parçalayarak mRNA’nın salınmasına izin verir. Bir mRNA’nın boyutu yaklaşık 100 nanometredir. Karşılaştırma için bir kağıt yaprağının yaklaşık 100.000 nanometre kalınlığında olduğunu söyleyebiliriz.
“Bu çalışmada geliştirilen LNP’ler, LNP’lerin hücreler içinde hızla bozunmasına olanak tanıyan yeni, asitle parçalanabilen bir bağlayıcı kullanıyor. Yeni bağlayıcı aynı zamanda daha az toksisiteye sahip LNP’lerin tasarlanmasına da olanak tanıyor” dedi Berkeley’deki Kaliforniya Üniversitesi’nden biyomühendislik profesörü ve projede araştırmacı olan Niren Murthy.
“Hücreler LNP’yi aldığında parçacıklar hücrenin endozomunun asidik ortamında parçalanır. Bu, mRNA’nın proteinlere çevrileceği hücre içindeki sıvı bileşen olan sitozole daha verimli ve daha erken salınmasıyla sonuçlanır. Wang, mRNA’nın verimli ve işlevsel olmasını istediğimiz yerin burası olduğunu söyledi.
Etkinlik toksisiteyle yakından ilişkilidir. Bu nedenle bir hücrenin yeterli miktarda protein üretebilmesi için alması gereken LNP taşıyıcı miktarının bilinmesi önemlidir. Emilim verimliliği düşükse, çok sayıda nanopartikülün kullanılması gerekecektir. Bu, toksik bir bağışıklık tepkisine neden olabilecek çoklu dozlar veya yüksek dozlar anlamına gelir.
Wang, “Şimdiye kadar mRNA’nın merkezi sinir sistemine iletilmesinin önündeki en büyük engel iltihaba yol açan toksisiteydi” dedi.
Çalışma, LNP yönteminin mRNA’nın çevrilmesinde daha etkili olduğunu ve potansiyel olarak toksik dozlara olan ihtiyacı azalttığını buldu. Makale, rahimdeki merkezi sinir sisteminin genetik hastalıklarını tedavi etmek için Cas9 mRNA’yı iletmek üzere LNP teknolojisinin kullanımını açıklamaktadır. Araştırmacılar, araçlarını nadir görülen bir nörogelişimsel durum olan Angelman sendromundan sorumlu gen üzerinde test etti.
Genetik bir bozuklukta hasar hamilelik sırasında ve doğumdan kısa bir süre sonra birikir. Araştırmalar, bebeklerde kan-beyin bariyeri tam olarak oluşmadan önce beyin hücrelerine tedavi uygulanmasının daha etkili olduğunu göstermektedir. Bu nedenle düzeltme ne kadar erken gerçekleşirse o kadar iyidir. Amaç hastalığın rahimde ilerlemesini durdurmaktı. [внутриутробно].
Araştırmacılar, fetal fare beyinlerinin ventriküllerine LNP’yi mRNA ile enjekte ettiler. MRNA, genleri düzenlemek için makas görevi gören bir protein olan CAS9’a çevrilir. Ortaya çıkan CAS9, Angelman sendromundan sorumlu geni düzenleyecektir.
“MRNA, işlevsel proteinler oluşturmak üzere parçaların bir araya getirilmesiyle ilgili talimatlar içeren bir Lego kullanım kılavuzu gibidir. Kafesin kendisi bir CAS9 oluşturmak için gereken tüm parçalara sahiptir. Sadece mRNA dizisini sağlamamız gerekiyor ve hücre onu alıp proteinlere çevirecek” diye açıkladı Wang.
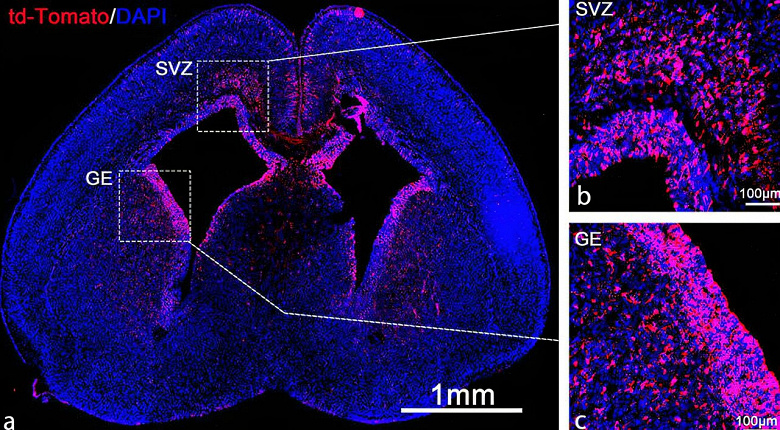
Çalışma, LNP aracının CAS 9’a çevrilen mRNA’yı iletmede oldukça etkili olduğunu buldu. Araştırmacılar, izleyiciler kullanarak beyin içinde düzenlenen tüm nöronları görebildiler. Çalışmaları, nanopartiküllerin beyinde gelişen nöral kök ve progenitör hücreler tarafından alındığını gösterdi. Nanopartiküller, fare beyni kök hücrelerinin %30’unda gen düzenlemesine yol açtı.
“Beynin tamamının yüzde 30’unun, özellikle de kök hücrelerin transfekte edilmesi büyük bir olay. Fetüs gelişmeye devam ettikçe bu hücreler göç edip beynin birçok bölgesine yayılıyor” dedi Wang.
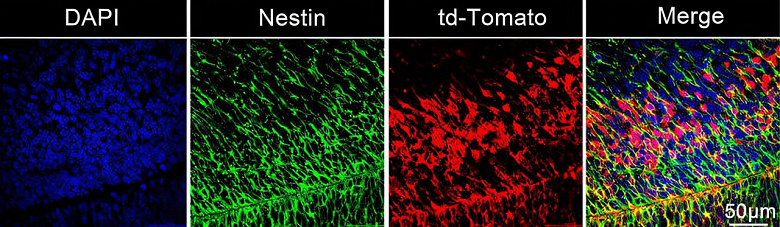
Araştırmada, fetüs geliştikçe kök hücrelerin çoğaldığı ve merkezi sinir sistemini oluşturmak üzere göç ettiği görüldü. Çalışma, hipokampustaki nöronların %60’ından fazlasının ve korteksteki nöronların %40’ının transfekte olduğunu buldu.
“Bu, merkezi sinir sistemini etkileyen genetik hastalıklar için çok umut verici bir tedavidir. Bebekler doğduğunda birçok nöron [уже] düzeltildi. Bu, bebeğin herhangi bir belirti olmadan doğabileceği anlamına geliyor” diye açıkladı Wang.
Wang, hastalıklı fare hücrelerinin daha da yüksek oranda transfekte edilmesini görmeyi bekliyor.
“Mutasyona uğramış nöronlar hastalık semptomlarının birikmesi nedeniyle ölebilirken, “iyi” nöronlar kalıp çoğalabilir. Bu, terapötik etkinliğin artmasına yol açabilir. Hücrelerin nasıl çalıştığı hakkında yeterince bilgi sahibi olursak, bu bilgiyi hücredeki doğal yollarla etkileşimde bulunmak için kullanabiliriz” dedi.
Araştırmacılar çalışmalarının, doğum öncesi testler sırasında teşhis edilebilecek genetik hastalıklara yönelik yeni tedavilerin geliştirilmesine yol açacağını umuyorlar. Ayrıca teknolojilerinin kanser ve nörolojik bozukluklar gibi diğer hastalıkların tedavisinde de kullanılabileceğini umuyorlar.
Bilim insanları teknolojinin etkinliğini ve güvenliğini artırmak için çalışmalarına devam etmeyi planlıyor. Ayrıca bu tedavinin insanlarda etkinliğini test etmek için klinik araştırmalar yapmayı da planlıyorlar.